Nội dung:
Trong ngành dược phẩm hiện đại, tiêu chuẩn GMP (Good Manufacturing Practices – Thực hành sản xuất tốt) ngày càng đóng vai trò chiến lược then chốt. Tại Việt Nam, ngày càng nhiều doanh nghiệp chủ động áp dụng hệ thống GMP không chỉ để đáp ứng quy định pháp lý mà còn nâng cao uy tín và chất lượng sản phẩm trên thị trường trong nước cũng như quốc tế. Với sứ mệnh đồng hành cùng doanh nghiệp Việt Nam trên con đường tiếp cận tiêu chuẩn toàn cầu, Viện Nghiên Cứu Phát Triển Chứng Nhận Toàn Cầu (GCDRI) chia sẻ bài viết chuyên sâu sau đây, nhằm làm rõ vai trò, cấu trúc và giá trị thực tiễn của GMP trong lĩnh vực sản xuất dược phẩm.
GMP là gì và vai trò của nó trong ngành dược phẩm?

🔗 Tham khảo: 5 Yếu Tố Cốt Lõi Trong Thực Hành Sản Xuất Tốt (GMP): Cơ Sở Đảm Bảo Chất Lượng Sản Phẩm
GMP là viết tắt của cụm từ tiếng Anh “Good Manufacturing Practices” – tức “Thực hành sản xuất tốt”. Đây là một hệ thống các nguyên tắc và hướng dẫn được thiết kế nhằm đảm bảo rằng quy trình sản xuất trong ngành dược phẩm tuân thủ nghiêm ngặt các điều kiện về vệ sinh, kiểm soát chất lượng và truy xuất nguồn gốc. Từ đó bảo đảm hiệu suất, độ an toàn và độ ổn định của sản phẩm thuốc trước khi đến tay người bệnh.
Tổ chức Y tế Thế giới (WHO) là một trong những cơ quan đầu tiên xây dựng bộ nguyên tắc GMP, với lần ban hành đầu tiên đã được xem xét và phê duyệt bởi Hội đồng Chuyên gia về Tiêu chuẩn Dược phẩm của WHO từ năm 1968. Từ đó đến nay, hệ thống GMP không ngừng được cập nhật để theo kịp tiến bộ của ngành công nghiệp dược phẩm toàn cầu.
Việc thực thi GMP không chỉ mang tính bắt buộc pháp lý mà còn là một cam kết đạo đức của nhà sản xuất vì sức khỏe cộng đồng. Một hệ thống GMP hiệu quả sẽ ngăn ngừa tình trạng sai sót, tránh nhiễm chéo, ô nhiễm vi sinh hoặc lẫn tạp chất trong quá trình sản xuất, đồng thời giúp các doanh nghiệp đạt được chứng nhận và mở rộng năng lực sản xuất chuẩn quốc tế.
Hệ thống quy định GMP tại Việt Nam: Căn cứ pháp lý và phạm vi áp dụng

🔗 Tham khảo: Tiêu chuẩn GMP: Hệ thống sản xuất chất lượng cao cần thiết cho doanh nghiệp hiện đại
Tại Việt Nam, Bộ Y tế đã chính thức ban hành Thông tư số 35/2018/TT-BYT ngày 22/11/2018 quy định cụ thể về “Thực hành tốt sản xuất thuốc, nguyên liệu làm thuốc (GMP)”. Đây là văn bản pháp lý quan trọng tạo hành lang để cơ sở sản xuất dược phẩm tổ chức và triển khai hệ thống GMP phù hợp với chuẩn quốc tế được điều chỉnh phù hợp cho điều kiện trong nước.
Theo đó, tiêu chuẩn GMP áp dụng cho các cơ sở sản xuất thuốc, nguyên liệu làm thuốc, bao gồm quy trình, thiết bị, cơ sở vật chất, con người và hệ thống quản lý chất lượng. Các yếu tố này cần được kiểm tra đánh giá định kỳ nhằm đảm bảo tính nhất quán, đồng đều và an toàn với toàn bộ các lô sản xuất.
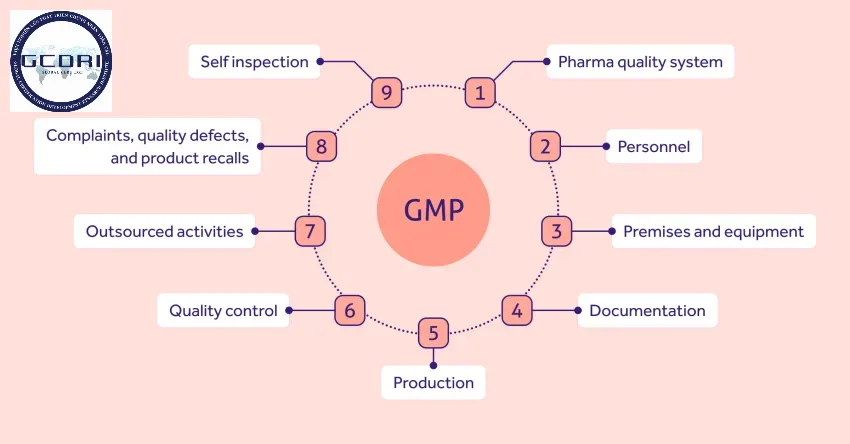
Nội hàm của GMP theo Thông tư 35/2018/TT-BYT bao gồm:
- Tuân thủ các nguyên tắc về điều kiện nhà xưởng: đảm bảo vệ sinh, bố trí hợp lý để tránh nguy cơ nhiễm chéo.
- Kiểm soát nguyên vật liệu đầu vào: chỉ sử dụng các nguyên liệu đạt tiêu chuẩn đã kiểm nghiệm.
- Chuẩn hóa quy trình công nghệ: mô tả chi tiết từng công đoạn sản xuất dưới dạng quy trình thao tác chuẩn (SOP).
- Đảm bảo hệ thống truy xuất và hồ sơ đối chiếu: sản phẩm phải được theo dõi từ nguyên liệu đến thành phẩm.
Việc đáp ứng đầy đủ các tiêu chí trên không chỉ giúp nhà sản xuất đạt chứng nhận GMP từ cơ quan chức năng mà còn nâng cao tính cạnh tranh, mở rộng hợp tác với các đối tác nước ngoài.
Lợi ích cốt lõi khi áp dụng hệ thống GMP trong sản xuất dược phẩm
Khi doanh nghiệp đầu tư và triển khai thành công mô hình GMP trong sản xuất thuốc, lợi ích không chỉ dừng lại ở khả năng tuân thủ quy định, mà còn đem lại những giá trị bền vững dài hạn. Cụ thể:
- Đảm bảo chất lượng sản phẩm: GMP là đối trọng quan trọng để ngăn ngừa sai sót trong sản xuất như nhiễm bẩn, sai liều hoặc mất ổn định hoạt chất.
- Bảo vệ người tiêu dùng: Sản phẩm được sản xuất theo GMP có độ an toàn cao hơn, chất lượng ổn định hơn – giúp tăng sự tin tưởng từ phía người bệnh và nhà phân phối.
- Gia tăng uy tín doanh nghiệp: Một nhà máy GMP được cấp chứng nhận bởi cơ quan có thẩm quyền giúp nâng cao vị thế doanh nghiệp với khách hàng, nhà thuốc cũng như đối tác quốc tế.
- Thúc đẩy xuất khẩu: Rào cản kỹ thuật là yếu tố lớn trong xuất khẩu dược phẩm. GMP là tiêu chuẩn nền tảng để tiếp cận các thị trường khó tính như EU, ASEAN, Nhật Bản…
- Cải tiến nội bộ và năng suất: Việc áp dụng GMP đồng nghĩa với tổ chức sản xuất khoa học, nhân sự được đào tạo bài bản, thiết lập hệ thống kiểm soát chặt chẽ – từ đó giúp tối ưu hiệu suất làm việc và giảm rủi ro lỗi lặp.
Kết luận: GMP – nền tảng không thể thiếu cho mọi doanh nghiệp dược vững mạnh
Hệ thống Thực hành sản xuất tốt thuốc (GMP) không chỉ là một yêu cầu bắt buộc về mặt pháp lý, mà là xương sống của mọi nỗ lực cải tiến chất lượng trong lĩnh vực dược phẩm. Việc chủ động triển khai, duy trì và nâng cấp hệ thống GMP là một chiến lược đầu tư dài hạn, mang lại giá trị thiết thực về chất lượng sản phẩm, uy tín thị trường và kỳ vọng phát triển bền vững.
Với vai trò là một tổ chức chuyên sâu trong lĩnh vực tư vấn và đào tạo các hệ thống chứng nhận quốc tế, Viện Nghiên Cứu Phát Triển Chứng Nhận Toàn Cầu (GCDRI) luôn sẵn sàng hỗ trợ doanh nghiệp Việt tiếp cận và áp dụng hiệu quả tiêu chuẩn GMP. Đừng bỏ lỡ cơ hội nâng tầm vị thế sản xuất của doanh nghiệp bạn – hãy kết nối ngay với chúng tôi qua Hotline: 0904.889.859 (Ms.Hoa) hoặc email: [email protected] để được tư vấn chuyên sâu và hỗ trợ toàn diện!
Hoa Linh là chuyên gia tư vấn và triển khai hệ thống quản lý theo tiêu chuẩn quốc tế ISO với hơn 8 năm kinh nghiệm hỗ trợ doanh nghiệp Việt Nam đạt chứng nhận ISO 9001, ISO 14001, ISO 45001, ISO 22000, ISO 27001 và ISO 50001. Với nền tảng kiến thức chuyên sâu về quản lý chất lượng, quản lý môi trường, an toàn lao động và an toàn thông tin, Hoa Linh đã đồng hành cùng hàng trăm doanh nghiệp trong đa dạng lĩnh vực như sản xuất, thực phẩm, logistics, xây dựng, dịch vụ thương mại và công nghệ. Khả năng phân tích hệ thống hiện tại của doanh nghiệp, tư vấn các giải pháp cải tiến phù hợp, xây dựng tài liệu ISO chuyên nghiệp, đào tạo đội ngũ nhân sự, đánh giá nội bộ và hỗ trợ doanh nghiệp làm việc với tổ chức chứng nhận quốc tế.
Hiện tại, Hoa Linh là chuyên gia của Viện Nghiên Cứu Phát Triển Chứng Nhận Toàn Cầu (GCDRI) và trực tiếp tham gia tư vấn - đào tạo - hỗ trợ doanh nghiệp đạt chứng nhận ISO theo yêu cầu của khách hàng và đối tác quốc tế.
Liên hệ với chúng tôi
VIỆN NGHIÊN CỨU PHÁT TRIỂN CHỨNG NHẬN TOÀN CẦU
| ⭐ Chứng nhận đạt chuẩn quốc tế | Viện Nghiên Cứu Phát Triển Chứng Nhận Toàn Cầu cung cấp chứng nhận có giá trị toàn cầu, đáp ứng tiêu chuẩn quốc tế. |
| ✅ Thủ tục đăng ký nhanh gọn | Với đội ngũ chuyên gia giàu kinh nghiệm, chúng tôi đảm bảo quy trình đăng ký chứng nhận đơn giản và nhanh chóng. |
| ✅ Chính sách hậu mãi sau chứng nhận | Hỗ trợ khách hàng lâu dài sau chứng nhận, đồng hành cùng sự phát triển bền vững của doanh nghiệp. |
| ⭐ Liên hệ | 📞 0904.889.859 |
Like fanpage GCDRI để nhận tin mới mỗi ngày!





